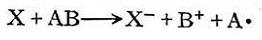過(guò)氧化氫引發(fā)劑的活化能為52千卡/克分子,,而其相應(yīng)的氧化還原體系H2O2-Ee"的活化能只有9,4千卡/克分子,,異丙苯過(guò)氧化氫的活化能為30千卡/克分子,,但其與亞鐵離子構(gòu)成的氧化還原體系的活化能只有12千卡/克分子。
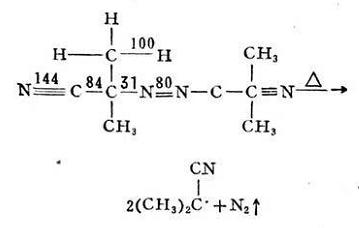
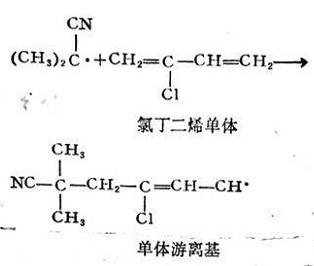
初級(jí)游離基尺·作用于單體分子時(shí),,激發(fā)雙鍵上的π電子,,使之分離為兩個(gè)獨(dú)立電子,這是需要活化能的,,R與其中一個(gè)獨(dú)立電子結(jié)合,,放出一定的能量,而生成單體游離基RM。
在上述兩步反應(yīng)中,,引發(fā)劑的分解是吸熱反應(yīng),,其分解活化能約為30千卡/克分子。而形成單體游離基的反應(yīng)是放熱反應(yīng),,活化能約為5~8千卡/克分子,,反應(yīng)極易進(jìn)行,反應(yīng)速度較快,,即初級(jí)游離基R?一旦生成后,,馬上就與單體M作用。故游離基RM的生長(zhǎng)率主要決定于引發(fā)劑的分解速度,。
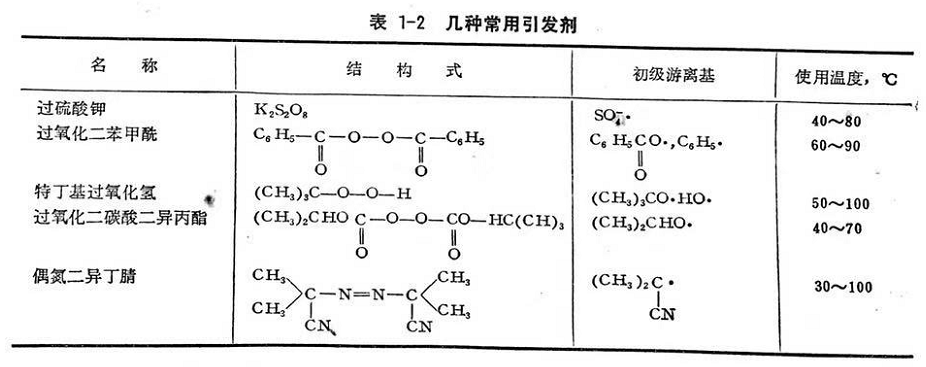
在鏈的引發(fā)階段存在著許多副反應(yīng),,主要是初級(jí)游離基或單體游離基與氧作用,或者是與雜質(zhì)作用,,這都將影響引發(fā)效率,。要使鏈引發(fā)順利進(jìn)行,就必須嚴(yán)格控制氧,、雜質(zhì)和阻聚劑,,以盡量減少副反應(yīng)。所謂阻聚劑就是一種捕提游離基的物質(zhì),,它能極迅速與初級(jí)游離基作用,,終止鏈反應(yīng)。當(dāng)聚合系統(tǒng)內(nèi)有阻聚劑時(shí),,就產(chǎn)生誘導(dǎo)期,,直到阻聚劑消耗完后,聚合作用才正常進(jìn)行,。通常,,為防止純凈單體在生產(chǎn)或貯運(yùn)中發(fā)生自然聚合現(xiàn)象,常在單體中加入少量阻聚劑(或叫穩(wěn)定劑),。如加入0.05~0.1%的對(duì)苯二酚等,。另一種阻滯劑或緩聚劑是只在反應(yīng)初期阻滯聚合速度,使聚合速度減低,,而不產(chǎn)生誘導(dǎo)期,。引發(fā)效率就是引發(fā)劑分解產(chǎn)生的游離基數(shù)目,用于形成單體游離基的百分?jǐn)?shù),,常用f%表示,。通常,由于副反應(yīng)的存在,,以及單體性質(zhì),、介質(zhì),、引發(fā)劑濃度和反應(yīng)溫度的影響,初級(jí)游離基的引發(fā)效率一般不能達(dá)到100%,。用同一種引發(fā)劑去引發(fā)不同單體,,引發(fā)效率也不同,見(jiàn)表1-3,。

因?yàn)橐l(fā)劑的分解速度直接關(guān)系到聚合速度,,所以需知道引發(fā)劑的分解速度。由于引發(fā)劑是以端基形式參與聚合物的組成,,加大引發(fā)劑用量,,雖可以加快整個(gè)聚合速度,但卻使聚合物平均分子量降低,。